Manganometrie:
Um den Kalkgehalt in 100 mL Leitungswasser zu bestimmen, werden die
Calcium-Ionen, die zusammen mit Carbonat-Ionen (CO32-)
Kalk (CaCO3) bilden, mit Oxalat-Ionen
(C2O42-) ausgefällt. Das Calciumoxalat
(CaC2O4) wird abfiltriert, mit Wasser gewaschen und
danach mit verd. Schwefelsäure behandelt, wobei Oxalsäure
(H2C2O4) und Calciumsulfat
(CaSO4) entstehen. Die Lösung wird mit
Kaliumpermanganat-Lösung
titriert
(ceq(MnO4-) = 0,1 mol/L);
es werden 6,0 mL
MnO4--Lösung verbraucht. Welche
Masse m Calciumoxid
ist in 1 Liter Wasser?
Lösung:
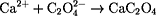
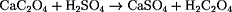
Oxidation:
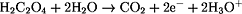
Reduktion:
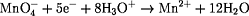
Redoxreaktion:
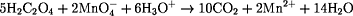
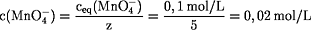
Stoffmenge MnO4- in 100 mL Leitungswasser:
n(MnO4-) = c(MnO4-) ·
V(MnO4-) = 0,02 mol/L · 0,006 L =
1,2·10-4 mol
Stoffmenge H2C2O4 in 100 mL
Leitungswasser:
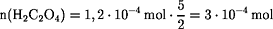
n(H2C2O4) = n(Ca2+) = n(CaO)
Stoffmenge CaO in 1000 mL Leitungswasser:
n(CaO) = 3·10-3 mol
m(CaO) = 3·10-3 mol · 56,08 g/mol = 0,1682 g = 168,2
mg










